摘要
最近流行的冠状病毒(CoV)对动物和人类健康构成严重威胁。目前,猪肠道冠状病毒(PECs)包括传染性胃肠炎病毒(TGEV)、新型猪急性腹泻综合征冠状病毒(SADS-CoV)、猪德尔塔冠状病毒(PDCoV)和猪流行性腹泻病毒(PEDV),它们感染不同年龄的猪,导致仔猪腹泻、呕吐和脱水,发病率和死亡率较高。PECs具有跨物种传播的潜力,正在给中国和世界的养猪业造成巨大的经济损失,因此需要紧急解决。本文就PECs的致病性、流行情况及诊断方法进行综述,为提高PECs的诊断、预防和控制水平提供参考。
1、传染性胃肠炎病毒猪传染性胃肠炎(TGE)
是由TGEV引起的一种高度传染性消化道疾病,其特征是2周龄以内仔猪出现呕吐、严重腹泻、脱水和高死亡率。该病于1946年在美国首次报告,随后在美洲、亚洲和欧洲的许多国家暴发。TGEV引起的临床症状的严重程度与猪群的年龄成反比。小于2周龄的仔猪最易受感染,出现呕吐、水样或泥状腹泻和黄色粪便,常伴有未消化的凝乳。仔猪体重迅速减轻,脱水,发病1周内死亡,死亡率可达100%。感染的泌乳母猪表现为短暂性体温升高、泌乳停止、呕吐、厌食和腹泻,持续时间短,很少死亡,而部分泌乳母猪无临床症状。
组织病理学变化主要发生在猪的胃和小肠。显微镜检查显示,小肠绒毛萎缩、缩短,甚至坏死。组织化学分析显示,TGEV感染猪的空肠中CD3+T细胞、SIgA阳性细胞和树突状细胞数量减少,而微折叠(M)细胞数量和细胞增殖增加。此外,本研究还发现,在TGEV感染猪的粘膜刮拭样品中,肠杆菌科基因拷贝数增加,乳酸菌数量减少。
TGEV是一个单股、正链RNA病毒,基因组长度约28.5 kb。开放阅读框(ORF)排列为5 ' -ORF1a-ORF1b-ORF2-ORF3a-ORF3b-ORF4-ORF5-ORF6-ORF7-3 ',其中ORF1a和1b占据了基因组长度的三分之二,分别编码pp1a和pp1b。ORF2、ORF4、ORF5、ORF6编码4种结构蛋白,分别为棘突蛋白(S)、膜蛋白(M)、核衣壳蛋白(N)、包膜蛋白(E),以及ORF3a、ORF3b、ORF7编码的3种辅助蛋白(图1A)。
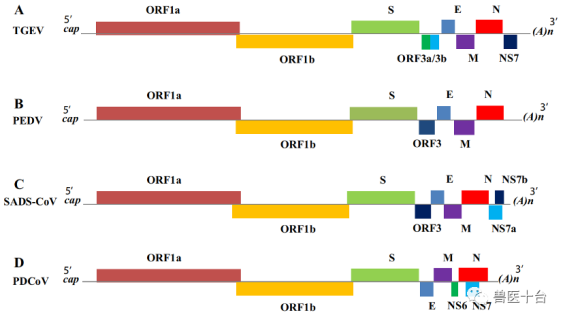
图1 猪肠道冠状病毒的基因组结构,包括TGEV (A)、PEDV (B)、SADS-CoV (C)和PDCoV (D)。
冠状病毒感染生物体的第一步是识别并结合宿主细胞膜受体分子,然后启动入侵和膜融合过程,最终将病毒基因组释放到受感染细胞中。整个过程是由冠状病毒S蛋白介导的。S蛋白是一种大型的I型跨膜糖蛋白,在功能上分为两个亚基,分别负责受体结合和与细胞膜融合。病毒与氨基肽酶N (APN)受体的结合位点位于TGEV S蛋白的S1亚基c端结构域。
冠状病毒S蛋白识别的受体类型和受体在宿主中的分布是决定易感动物的种类和组织趋向性的关键因素。目前已知的冠状病毒功能受体有四种,分别是APN(作为TGEV的受体)、血管紧张素转换酶2 (ACE2;作为严重急性呼吸综合征冠状病毒受体),癌胚抗原相关细胞粘附分子1 (CEACAM1;作为小鼠肝炎病毒的受体)和二肽基肽酶4 (DPP4,也称为CD26;用作中东呼吸综合征冠状病毒的受体)。
传统的TGEV毒株可进一步分为Miller亚群和Purdue亚群。近年来发现TGEV的发病率低于其他肠道冠状病毒,并常与PEDV、轮状病毒等其他病原体混合感染。从中国江苏省的一个养猪场分离出一株高毒力TGEV JS2012毒株。重组分析表明,该毒株是一株介于Miller M6和Purdue 115之间的天然重组毒株,可导致新生仔猪死亡率达100%。
2、猪流行性腹泻病毒猪流行性腹泻(PED)
是由PEDV引起的一种高度传染性肠道疾病,其特征是急性水样腹泻、呕吐和脱水。第一例PEDV病例于1971年在英国的一个养猪场报告,但PEDV于1978年在比利时首次被分离出来。在中国,PEDV于20世纪80年代首次被发现,在一些亚洲国家,包括日本和韩国也有报道。
所有年龄的猪都可感染该病毒,但仔猪,特别是2周龄以下的仔猪,死亡率高达95%。临床症状与TGE非常相似。PEDV主要感染小肠绒毛上皮细胞,导致肠绒毛明显萎缩。在感染PEDV的猪小肠内,绒毛肠细胞紧密连接被破坏,粘蛋白数量减少,许多肠细胞(如上皮细胞和杯状细胞)丢失,消化酶,如双糖酶(乳糖酶、蔗糖酶、麦芽糖酶)、亮氨酸氨基肽酶、碱性磷酸酶等明显减少,导致吸收和消化不良。肠道完整性受损可能导致肠道内食物和细菌的摄入,引起过敏反应和混合感染,进一步加重疾病。此外,还发现PEDV感染呼吸道的肺泡巨噬细胞,导致肺部病变。
PEDV基因组(约28 kb)与TGEV相似, ORF排列5 ' -ORF1a-ORF1b-ORF2-ORF3-ORF4-ORF5-ORF6-3 '。ORF1a编码一个大的多聚蛋白pp1a,而ORF1b在基因组5 '端的前2/3通过核糖体移框表达为pp1ab融合蛋白。pp1a和pp1b通过NSP3和NSP5的蛋白酶活性进一步加工成16种非结构蛋白(NSPs)。基因组末端1/3包含5个ORF,分别编码4个结构蛋白(S、E、M、N)和1个辅助蛋白(图1B)。
最新一项研究证实PEDV可瞬间感染鼻上皮细胞。鼻粘膜下层的树突状细胞(Dendritic cells, DCs)可伸出树突进入鼻腔吸收PEDV,并协助PEDV穿越粘膜。然后,携带PEDV的DCs将病毒传递给CD3+T细胞。通过血液和淋巴循环,携带病毒的CD3+T细胞到达肠上皮细胞,在肠道发生感染。本研究结果揭示了PEDV经鼻传播引起肠道致病性的新机制。
已知PEDV有两种基因型,基因I型 (GI)和基因II型 (GII)。GII型可分为GII-a、GII-b和GII-c三个亚型。中国和美国以GII毒株为主。2010年10月,中国南方暴发了由一种高毒力变异PEDV引起的严重PED疫情,死亡率为70-100%。此后,在美国、加拿大、墨西哥、奥地利、比利时、法国、德国和意大利等其他国家也报道了PEDV高毒力毒株的检测。
目前,在美国流行的PEDV毒株包括NON-INDEL (USA/Kansas29/2013)和S-INDEL (USA/OH851/2014),这两种毒株都被分类为GII。在实验感染中,NON-INDEL毒株的致病性和死亡率(高达100%)高于S-INDEL菌株(死亡率为0 - 70%)。
3、猪急性腹泻综合征冠状病毒
2016-2017年,中国科学家在广东省四个农场的腹泻猪中发现了一种新的肠道冠状病毒,并将其命名为SADS-CoV,也称为SeACoV。截至2017年5月,SADS-CoV已导致约25000头猪死亡。
基因测序和分析显示,该病毒基因组序列与2013-2016年在香港和广东从中华菊蝠(在离暴发SADS-CoV的猪场不远的一个洞穴中发现)中分离的蝙蝠冠状病毒HKU2的基因组序列一致性超过95%。这些结果证实,来自蝙蝠的新型冠状病毒是2016-2017年广东省猪场仔猪致死性腹泻的病原体。
SADS-CoV基因组约27.2 kb, ORF序列为5′-ORF1a-ORF1b-ORF2-ORF3-ORF4-ORF5-ORF6-ORF7a/b-3′。SADS-CoV基因组5 '末端的ORF1a和1b分别编码pp1a和pp1b,而3 '末端区域编码4种结构蛋白(S, E, M, N)和一些属特异性附属基因。据推测,编码NSP7a和下游NSP7b(重叠NSP7a)的ORF位于SADS-CoV基因组N基因的3 '端。HKU2和SADS-CoV株均含有NSP7a,而NSP7b仅存在于SADS-CoV中(图1C)。
关于SADS-CoV的报告相对较少,因为它仅在中国广东和福建两省被发现,发病率为10%。该疾病的临床症状与其他已知的PECs引起的疾病非常相似,主要特征是呕吐、腹泻,新生仔猪死亡率高。SADS-CoV感染后,病变主要发生在小肠,特别是空肠和回肠,导致肠壁变薄,肠腔内大量填充黄色水样粪便。SADS-CoV感染导致肠绒毛缩短,毛细血管和中央乳糜管被破坏,这可能是肠道功能丧失的主要原因。值得注意的是,SADS-CoV与目前猪场流行的TGEV、PEDV、PDCoV之间没有交叉反应,说明现有PEC疫苗对SADS-CoV感染没有交叉保护作用。
4、猪德尔塔冠状病毒
猪德尔塔冠状病毒病(PDCoVD)是一种以猪德尔塔冠状病毒(PDCoV)为主的新型肠道传染病,临床表现为水样腹泻和呕吐。PDCoVD于2012年在中国香港首次报道,2014年首次在美国暴发。随后,加拿大、韩国、越南等多个国家相继报道,造成严重经济损失。
与PEDV相比,PDCoV感染的临床症状较轻,新生仔猪死亡率为30 ~ 40%。然而,混合感染PEDV、TGEV或猪轮状病毒更为常见,并导致更严重的临床症状。PDCoV引起的组织病理变化与其他PECs相似,引起肠上皮细胞急性坏死,肠绒毛萎缩脱落,肠壁变薄,肠道功能障碍,机体对水的吸收减少,导致腹泻。
PDCoV基因组长约25.4 kb,结构与其他冠状病毒相似,两端均有非编码区。PDCoV基因组的5 '端3/4包含两个重叠的ORF, ORF1a和ORF1b,分别编码两个聚合酶蛋白pp1a和pp1b,其余基因组编码四个结构蛋白(S, E, M和N)。
PDCoV还表达三个辅助蛋白,NSP6(在M和N基因之间)和NSP7/NSP7a(在N基因内)(图1D)。
PDCoV已在中国、美国、韩国和泰国被发现。在这些国家,PDCoV的流行率低于PEDV。与PEDV等其他肠道病原体混合感染在PDCoV阳性样本中很常见,感染PDCoV的腹泻猪中有56%被发现感染PEDV。通过对现有PDCoV基因组序列的比较,发现不同国家(如中国、美国和韩国)分离的PDCoV株的核酸序列具有高度同源性。它们也与原始序列HKU15高度同源,表明PDCOV的进化相对保守。
参考文献:

【版权说明】来源:兽医十台。猪博士平台转载的文章均已注明来源、猪博士平台原创文章其他平台转载须注明来源,特别说明的文章未经允许不可转载。由京津冀区整理发布,我们发布的文章仅供养猪人学习参考,不构成投资意见。如有不妥,请联系客服删除。




发表评论 取消回复